2020年1月24日,国际知名学术期刊ProcNatl Acad Sci U S A正式接收了“发育与疾病相关基因”教育部重点实验室谢维课题组李默怡副研究员、庄燕博士生等有关RNA选择性剪接因子HNRNPA1在神经肌肉疾病强直性肌营养不良中的新作用机制的研究成果(HNRNPA1-induced spliceopathy in a transgenic mouse model of myotonic dystrophy, ProcNatl Acad Sci U S A, 2020)
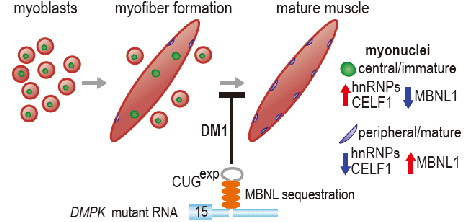
RNA选择性剪接广泛存在于真核生物细胞中,并在组织器官正常发育与成熟细胞正常功能的维持过程中都发挥着至关重要的作用。强直性肌营养不良1型(DM1)是最早被发现由于微卫星DNA异常扩增而导致非编码RNA产物与RNA剪接因子相互结合使RNA剪接因子活性丧失从而造成广泛RNA选择性剪接异常的一种单基因遗传病。长久以来,研究人员普遍认为RNA剪接因子MBNL1及其家族成员在DM1细胞中的功能下调(成年剪接产物的减少)与另一RNA选择性剪接因子CELF1的上调(胚胎剪接产物的增加)是DM1相关剪接异常事件发生的主要机制,但是这一模型尚不能解释所有DM1相关剪接事件的发生。李默怡等应用DM1小鼠模型HSALR、体外成肌细胞等研究发现,RNA剪接因子HNRNPA1能够作用于与MBNL1参与剪接的DM1异常剪接位点,促进胚胎剪接产物的形成。CLIP-seq显示HNRNPA1可以与DM1异常剪接位点直接相互结合并与MBNL1竞争结合位点;在DM1病人的RNA-seq数据库及活检样本中也搜索和检测到显著的HNRNPA1转录本及相应蛋白质水平的上调。这一系列研究表明HNRNPA1是一个新的DM1作用因子,与CELF1共同作用于DM1选择性剪接位点,通过与MBNL1竞争结合调控该位点的剪接产物;异常剪切导致强直性肌营养不良1型疾病的发生。
本研究为DM1异常选择性剪接表型提出了新的模型,为微卫星不稳定扩增导致的神经遗传疾病相关病理机制的阐明及可能的个性化治疗提供了新思路。
该工作也得到了佛罗里达大学Maurice Swanson教授及解放军总医院的长期大力支持;得到国家自然科学基金、中国博士后科学基金和美国NIH科学基金的资助。